מאז המצאת הכימותרפיה, לפני יותר מ-50 שנה, לא חלה התקדמות של ממש בתחום הטיפול בסרטן, אבל בשנים האחרונות שוטף את מעבדות המחקר ומכוני הטיפול גל של התפתחויות חדשות ומרהיבות, שכותרת הגג שלהן היא "אימונותרפיה", כלומר גיוס מערכת החיסון לחיסול הגידול. לראשונה, גידולים סרטניים עם גרורות מתכווצים ונסוגים למשך כמה שנים, לעתים אפילו נעלמים, ותופעות הלוואי של התרופות חמורות הרבה פחות.
ההתפתחויות האחרונות מתבססות על התובנה הבאה: בכל אחד מאיתנו מתרחשת בכל רגע נתון פעילות סרטנית: תאים עוברים שינויים בגוף ומתחילים להתרבות ללא בקרה. אצל רובנו, רוב הזמן, מערכת החיסון מאתרת את התאים הללו ומחסלת אותם, אבל מדי פעם גדל לו תא סרטני שמצליח לנצח את מערכת החיסון - הוא ניחן ביכולת להתחבא מפניה, לדכא אותה, להתגבר על שדרים שהיא מעבירה לו ולפיהם עליו להתאבד או שהוא פשוט גדל מהר מכדי שתוכל להרוג אותו. הגידולים הללו הם אלה שהופכים אלימים. מערכת החיסון לא יודעת איך לנצח אותם מבפנים, ואנחנו לא יודעים איך לנצח אותם מבחוץ.
הרעיון שהמפתח לטיפול בסרטן מצוי בהבנה של מה עושה הסרטן למערכת החיסון עלה כבר לפני מאה שנה, אבל רק עכשיו מתחילים לפצח את החידה. הרעיון הבסיסי הזה הוא גאוני, משום שמערכת החיסון היא הגורם המתאים ביותר לחיסול הסרטן. היא מסוגלת להגיע לכל גרורה וגרורה בגוף, לכל תא, דבר ששום כימותרפיה או נוגדן או הקרנה לא יצליחו לעולם לעשות, שלא לדבר על ניתוח. יותר מכך, היא יודעת להתאים את מאבקה במהירות למוטציות בתאים הסרטניים. לו היינו צריכים לייצר במעבדה תרופה נגד כל מוטציה אפשרית של סרטן, לא היינו יכולים לעשות זאת. מערכת החיסון עושה זאת בקלות יחסית.
אפשר לתאר את מה שקורה היום בתחום האימונותרפיה כמלחמת גוג ומגוג בין שני כוחות: מערכת החיסון האנושית, בתגבור המוח האנושי והמדע, נגד הגידול הסרטני שמנסה להתחכם בכל דרך. ככל שמערכת החיסון נעשית מתוחכמת יותר, כך הסרטן מוצא דרכים חדשות לחמוק ממנה, ממש כמו במלחמה בין האקרים לחברות אבטחה.
לפני שנצלול לפרטי קרב האימתנים הזה, רצינו לברר מה זה בכלל הדבר הזה שנקרא סרטן - תקלה בגוף? איבר נוסף? חוקר הסרטן ד"ר גל מרקל מתקשה, יותר מכפי שהיינו מצפים, להשיב. "זה חלק מהגוף שהפך לבוגד ופיתח כלים מתוחכמים של שימור עצמי, ממש כאילו היה יצור בפני עצמו או לפחות איבר, אבל הוא עצמנו, בשר מבשרנו", הוא אומר, "נראה שיש לו יצר הישרדות לפחות במידה שיצורים חיים אחרים הם בעלי יצר כזה, אבל הוא לא חי מחוץ לגוף או בנפרד מהגוף, כולו עשוי מהתאים שלנו, ובסופו של דבר הוא הורג את 'מארחו', כך שהוא לא כל כך חכם או הישרדותי".
התרופות האימונותרפיות הן היום בין היקרות בשוק התרופות העולמי, אבל אם הן אכן ייצרו תגובות חיוביות בחולים רבים הן יצדיקו בהחלט את מחירן לעומת הטיפולים הממושכים והטיפולים התומכים שניתנים היום לחולי סרטן סופניים. כל תרופה וכל התוויה חדשות לשוק הזה צפויות להגדילו במאות מיליוני דולרים נוספים. אנליסט בנק ההשקעות סיטי העריך ב-2013 שתחום האימונותרפיה יגלגל עד 2023 כ-35 מיליארד דולר וכי אלה יהיו הטיפולים המובילים לסרטן. מתוך ה-35 מיליארד, הוא צפה שתחום נקודות הבקרה לבדו (ראו למטה) יגלגל 24 מיליארד דולר.
חפשו את התקלה במחסום: הטכנולוגיה שכמעט פוספסה
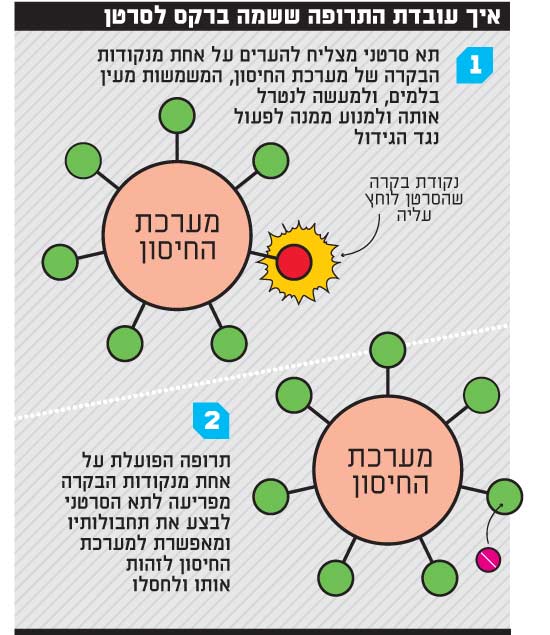
אחד הגילויים החשובים בתחום האימונותרפיה היה המנגנון העיקרי שבו תא סרטן מצליח לחמוק ממערכת החיסון. חוקרים גילו שעל תאי מערכת החיסון יש "נקודות בקרה" ("אימיון צ'קפוינט"), מעין "בלמים" שהפעלתם מונעת את פעילות מערכת החיסון. רוב תאי הסרטן אינם יודעים להפעיל את הבלמים האלה, וכך מערכת החיסון מחסלת אותם בקלות, אבל אחת לכמה זמן ייווצר תא סרטני שיפריש חומר הפוגע באחד הבלמים ומדכא את מערכת החיסון בסביבת הגידול.
הרעיון בבסיס התרופות החדשות הוא כזה: במקום לתקוף את הגידול הסרטני, נפריע לו לבצע את פעולתו על מערכת החיסון, כלומר נפריע לו "ללחוץ על הבלם" וכך נעורר את מערכת החיסון והיא תוכל שוב לאתר את האויב ולחסלו.
רנזו קנטה, קובע מדיניות האונקולוגיה במחלקת המו"פ של חברת בריסטול מייר סקוויב (BMS), שהוציאה לשוק את התרופה הראשונה בתחום הזה, מספר כיצד הטכנולוגיה כמעט פוספסה. לדבריו, היא התאפשרה רק הודות לערנות והסקרנות של המדענים וערנות החולים. "אנחנו רגילים למדוד הצלחה של טיפול בכך שהגידול מתכווץ, אבל רק בחלק קטן מהחולים שנתנו להם את התרופה שכל כך האמנו בה הגידול אכן התכווץ", אומר קנטה, "אצל חלקם ראינו שהוא דווקא גדל. אמרנו לאותם חולים: 'אנחנו מצטערים, אין לנו מה לתת לך', והנה, אחרי כמה זמן פגשנו שוב את החולה והוא אומר, 'תשמע, זה מוזר, אני מרגיש יותר טוב'. מיד שינינו את הפרוטוקולים שלנו כדי לא לשלוח הביתה חולים שהגידול שלהם לא התכווץ אבל הם מרגישים טוב יותר, ובבדיקה מעמיקה יותר גילינו שהגידול צמח דווקא משום שהוא היה מלא בתאי T (תאים של מערכת החיסון - ג"ו). הגידול צמח משום שהתחולל בו קרב אימים בין תאי הסרטן לתאי מערכת החיסון שהצליחו לחדור לתוך הגידול. קודם לכן הם לא יכלו לעשות זאת".
בסופו של דבר הגידולים כן התכווצו. 10 שנים חלפו מאז הטיפול הניסיוני, וכמה חולים שטופלו בשיטה הזאת עדיין חיים. אמנם לא בכל החולים התוצאות היו טובות, ובכל זאת מדובר בצוהר של תקווה. כל החולים שטופלו באותה נקודת זמן היו כאלה שגזר דינם נחתם. רובם היו חולי מלנומה (סרטן העור) עם גרורות במוח, בכבד ובריאה. לדברי רנטה, 25% מהם החזיקו עוד שנים רבות, "ואצל מי ששרד שנתיים, כמעט שלא ראינו חזרה של הסרטן".
התרופה הראשונה של BMS, ששמה Yervoy, מאושרת היום לטיפול במלנומה והיא פועלת על נקודת בקרה במערכת החיסון ששמה CTLA4. לאחר שנה של טיפול, 46% מהחולים היו עדיין בחיים, זמן כמעט כפול מזה שצפו להם. לאחר שנתיים, 24% מהחולים היו עדיין בחיים. בניסוי מעקב שכלל את כל החולים שטופלו בתרופה בניסוי זה ובאחרים, נמצא ש-22% מהחולים שרדו שלוש שנים לפחות. למעשה, המוצר הזה הוא היחיד שנמצא בשוק יותר משנה. ברבעון השלישי הוא רשם הכנסות של 350 מיליון דולר, נתון שניתן לתרגם ליותר ממיליארד דולר בשנה. Yervoy נמכרת לצרכן בכ-120 אלף דולר בארה"ב. בארץ היא בסל התרופות לחולי מלנומה.
החיסרון הגדול של התרופה הזאת הוא תופעות הלוואי הקשות שלה. הן כוללות מגוון תופעות אוטואימוניות, שבהן מערכת החיסון תוקפת בעצמה את הגוף. תופעות הלוואי הללו מתרחשות משום שהורדנו את ה"בלמים" ממערכת החיסון, וכך קיבלנו מערכת חיסון פעילה מדי גם באזורים אחרים בגוף. ניתן לדכא אותה בסטרואידים או תרופות אחרות, אבל אז החולה חשוף למחלות זיהומיות.
הדורות הבאים של התרופות האימונותרפיות כבר נראים טוב יותר מהבחינה הזאת. לבריסטול עצמה וגם לחברת מרק האמריקאית יש תרופות מתקדמות העובדות על נקודת בקרה אחרת בשם PD1. המוצרים Keytruda של מרק ו-Opdivo של BMS נרשמו לשיווק רק בחודשים האחרונים (קייטרודה כבר אושר בארה"ב ומתומחרת בארה"ב בכ-150 אלף דולר בשנה, אופדיבו מאושרת ביפן ומחכה לאישור בארה"ב), ומוקדם מכדי לדעת מה יהיה היקף ההכנסות שלהן, אך לאור התוצאות שלהן, הן כנראה יאומצו באותה מהירות של התרופה החלוצה. גם לחברה ישראלית בשם קיורטק יש תרופה הפועלת במנגנון הזה, אך היא נמצאת בשלבים מוקדמים יותר.
על פי ניסויים שנערכו עד היום, נראה שמשפחת ה-PD1 פחות רעילה מהדור הקודם והתוצאות מלהיבות: בניסוי של בריסטול, למשל, 41% מהחולים שרדו שלוש שנים. שילוב של תרופות PD1 עם הדור הקודם השיגו עד כה שרידות של 80% למשך שנתיים. אלה תוצאות שגורמות לאונקולוגים לצאת לרקוד, עם מטופליהם.
"ידענו מלכתחילה שלא נסתפק בתרופה מצליחה אחת. על בסיס המדע הזה ניתן לבנות מערך שלם של תרופות אונקולוגיות", אומר קנטה. עד היום נעשו רוב הניסיונות במלנומה, שנחשבת הסרטן הכי רגיש למניפולציות חיסוניות, אולם ניסיונות בסרטנים נוספים, כמו סרטן ריאות, הראו תוצאות יפות ביחס לטיפולים הקיימים.
לדברי קנטה, "בעקבות הפעילות בתחום הזה, BMS החליטה לנטוש לגמרי את הפעילות שלה בתחום הכימותרפיה ולא לפתח תרופות כימותרפיות חדשות, אף שבעבר הייתה לנו הצלחה רבה בתחום הזה".
איך עובדת התרופה ששמה ברקס לסרטן
הסוד הוא בשילוב: האסימון של קומפיוג'ן נפל
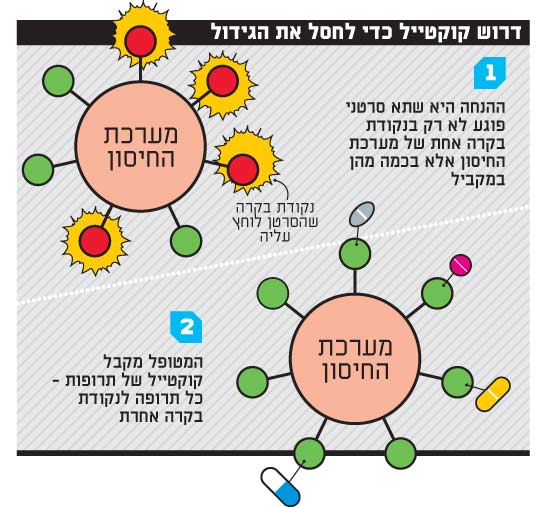
דבריו של קנטה מובילים אותנו לדור הבא-הבא של האימונותרפיה. עכשיו החוקרים כבר שואלים: אם התרופה אפקטיבית כל כך, מדוע היא לא עובדת בכל החולים, ומדוע היא אינה משיגה תמיד תוצאות של 100% נסיגה בחולים שכן מגיבים? התשובה אולי טמונה בכך שתרופות אימונותרפיות עובדות טוב יותר כשמשלבים ביניהן.
יעקב שכטר, שהקים ומנהל את מכון אלה לטיפול משולב במלנומה בביה"ח שיבא, מסביר: נראה שהסרטן מפעיל מגוון של מנגנוני הגנה מפני מערכת החיסון. גידולים שונים יכולים לפעול על "נקודות בקרה" שונות, ואותו גידול יכול להפעיל כמה נקודות בקרה, וכן הלאה. הבשורה המשמחת היא שכנראה אין אינסוף נקודות בקרה. כמה יש? אף אחד לא באמת יודע. כיום חברות התרופות הבינלאומיות עובדות על כארבע-חמש נקודות בקרה שונות ועל שילובים ביניהם. בחברת CCam (סיקאם) הישראלית, שצמחה במכון אלה ובראשה עומד ד"ר מרקל (שהוא גם מנהל המחקר של מכון אלה), גילו נקודת בקרה חדשה בשם Ceacam1 ובקרוב יחל ניסוי קליני בתרופה המתערבת במניפולציות שהסרטן מפעיל עליה. בין המשקיעים: חברת רוש הבינלאומית, הקרנות אורבימד ופונטיפקס ומורי ארקין. מרקל מאמין שיש כ-10-15 נקודות בקרה כאלה במערכת החיסון, וכי תרופות הקומבינציה הן שיביאו את הניצחון.
אם בסיקאם השקיעו גורמי מפתח על בסיס הגילוי של נקודת בקרה אחת, הרי שבחברת קומפיוג'ן הישראלית טוענים שגילו 11 חלבוני בקרה חדשים, בעלי פוטנציאל לוויסות הפעילות של מערכת החיסון, וכבר יש לה הוכחות ראשוניות במעבדה לפעילות של שש מהם. קומפיוג'ן פיתחה תהליך שיטתי לגילוי נקודות בקרה חדשות, וכיום ברשותה אחת מנצרות התרופות המוקדמות הרחבות בעולם של חלבוני בקרה של מערכת החיסון. במשך 15 שנה פיתחה החברה פלטפורמות חישוביות מתוחכמות לגילוי חלבונים וגנים אבל לא הצליחה לתרגם את הגילויים להצלחה מסחרית, ולכן נתפסה באותן שנים כחברה מרתקת מבחינה מדעית, אבל ללא "תכלס", ובקיצור: אכזבה. ואז הבינה מנכ"לית החברה, ד"ר ענת כהן-דייג, שיכולות הגילוי שפיתחו לאורך השנים מתאימות לגילוי נקודות בקרה חדשות במערכת החיסון, ועל כך חברת התרופות יהיו מוכנות לשלם.
"חשוב לזכור שכל התעשייה מכוונת לנקודות בקרה כמו PD1, לא כי בדקו את כל האפשרויות וראו שזו הכי טובה, אלא כי זו הייתה בין המולקולות הראשונות שגילו. אולי יש נקודות בקרה עוד יותר טובות? אנחנו גילינו עוד 11 חלבוני בקרה חדשים בעלי פוטנציאל לשמש לפיתוח תרופות לטיפול בסרטנים נוספים או בחולים שאינם מגיבים לטיפולים הקיימים. למיטב ידיעתנו, זה מאגר שאינו קיים באף חברה אחרת ויש לו פוטנציאל לשנות באופן משמעותי את תחום האימונותרפיה בסרטן", אומרת כהן-דייג.
ב-2013 חתמה קומפיוג'ן עם חברת בייר העולמית על הסכם שבו רכשה בייר רישיון לפתח תרופות התוקפות שתיים מנקודות הבקרה החדשות שגילתה קומפיוג'ן תמורת 10 מיליון דולר באופן מיידי, יותר מ-530 מיליון דולר עבור תשלומי אבני דרך בפיתוח, כמו גם תמלוגים ממכירות עתידיות, אם הפיתוח יניב תרופות שייצאו לשוק. מדובר בעסקה יפה מאוד, משום שבעת החתימה לא הייתה בידי קומפיוג'ן תרופה. קשה לדמיין שעסקה כזאת הייתה נחתמת בתחומים פחות "חמים", ודאי לא בסכומים כאלה. עד כה עמדה קומפיוג'ן בשתי אבני דרך בפיתוח הפרה-קליני, שעליהן זכאית החברה לתשלום של יותר מ-7 מיליון דולר.
היום, במסגרת ההסכם, קומפיוג'ן עובדת על פיתוח התרופות יחד עם בייר ואף הקימה בסן פרנסיסקו מעבדה שבה מייצרים את הנוגדנים, כך שהיא בסופו של דבר תוכל להציע את הפתרון המלא - גם את המטרה וגם את כלי הנשק לתקיפה, התרופה.
בצינורות הפיתוח של חברות התרופות אפשר למנות היום 16 תרופות בשלבי ניסוי מתקדמים, שנועדו לתקוף שבע נקודות בקרה במערכת החיסון. חלק מהניסויים משלבים בין כמה תרופות. ההערכה היא שבעתיד הלא רחוק קוקטייל תרופות המותאם למצבו של מטופל מסוים יהיה הפתרון לסרטן.
כמעט כל התרופות מנוסות תחילה בחולים במלנומה, וזה מעלה את השאלה עד כמה הדיבורים האופטימיים רלוונטיים לחולי סרטן אחרים.
מרקל: "אם בעבר הגדירו סרטנים מסוימים כ'אימונוגנים', כלומר קשורים במערכת החיסון, ומלנומה בראשם, היום המחשבה על כך השתנתה. יש סוגי סרטן עם מוטציות תדירות ורבות המקשות על תקיפת הגידול בדרכים קונבנציונליות, אולם דווקא סוגי סרטן כאלה חשופים יותר למערכת החיסון וקל לה יותר 'להתביית' עליהם. זה יכול להסביר מדוע בסרטן הריאות, שנחשב בעבר 'לא אימונוגני', התוצאות טובות".
פרופ' ניר פלד, מיחידת סרטן הריאה במרכז דוידוף לסרטן בבית החולים בילינסון, מוסיף: "אנחנו רואים כבר היום בטיפולים הניסיוניים שנערכים אצלנו הארכת חיים משמעותית. מי שחשבנו שיש לו חודשיים לחיות שורד יותר משנה, עם תופעות לוואי מינימליות. אנחנו מתחילים לפתח כלים שיעריכו אילו חולים מתאימים לקבל את הטיפול הזה כקו ראשון, כדי שיוכלו לקבל תוצאות טובות בלי לעבור לעולם דרך הכימותרפיה".
ד"ר כהן-דייג: "נראה שהתוצאות הן בהחלט בדרך לריפוי סרטן. כבר מעזים היום לדבר על כך, וזו השאיפה. התחום הזה הוא פריצת הדרך המשמעותית ביותר בחקר ובטיפול בסרטן עד היום".
דרוש קוקטייל כדי לחסל את הגי
טכנולוגיית הטיל: כבר לא כל כך סקפטים
תחום האימונותרפיה כולל בתוכו הרבה יותר מתקיפת תאי T בנקודות הבקרה של מערכת החיסון. רק לפני שבוע הצגנו ב"גלובס" את הפעילות של חברת אפרנת למשל, שמשחררת מאחיזתו של הסרטן זרוע אחרת לגמרי של מערכת החיסון, המקרופגים. חברות אחרות פועלות גם הן בשיטות יצירתיות כדי לרתום את מערכת החיסון למלחמה בגידולים הסרטניים. אחת מהן, המעוררת עניין לפחות כמו נקודות הבקרה, ומשיגה תוצאות שנראות אפילו טובות יותר בסרטנים מסוימים, היא התרפיה התאית למערכת החיסון.
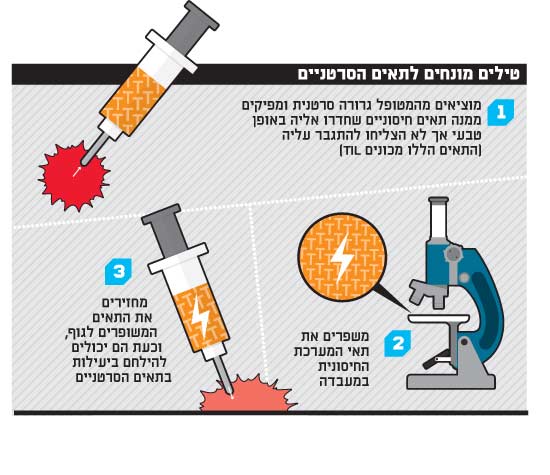
אחת הטכנולוגיות המעניינות בתחום הזה נקראת השם המתאים בהחלט - TIL. תאי ה"טיל" הם תאים מסוימים של מערכת החיסון שהצליחו לחדור באופן טבעי לגידול אבל הם לא מצליחים להשמידו משום שהם לא חזקים או לא משופעלים מספיק. בתרפיה תאית, מוציאים מהמטופל גרורה (בדרך בכלל מדובר בחולים במצב קשה מאוד), מפיקים ממנה את תאי ה-T החודרניים ומשפרים אותם במעבדה. במקביל הורגים את מערכת החיסון הקיימת של המטופל (כמו בהשתלת מוח עצם) ומשתילים את תאי ה-T המשופרים. מערכת החיסון המשופרת אפקטיבית מאוד בחיסול הגידול.
כשרק החלו בניסויים, כולם, כמה צפוי, היו סקפטיים. פרופ' סטיב רוזנברג מ-NIH, מכון מחקר הבריאות הלאומי של ארה"ב, הראה הצלחות במעבדתו, אבל לא ניתן היה לשחזר אותן במקומות אחרים. הרבה גבות הורמו, עד שהתוצאות שוחזרו דווקא במקום אחד נוסף: מכון אלה בתל השומר.
מרקל נלהב מאוד מטכנולוגיית ה-TIL. "טיפלנו ב-100 חולים שכל התרופות הקודמות נכשלו בטיפול בהם, וכ-35% השתפרו באופן משמעותי", הוא אומר. "המחלה נסוגה באופן חלקי עד מלא, ובערך ב-10% מהחולים הסרטן נעלם. יש לנו חולה שחי על התרופה הזו כבר 7.5 שנים. גם חולים שהמחלה שלהם נסוגה רק באופן חלקי מרוויחים פרקי זמן ארוכים של חיים נורמליים".
מרקל מאמין מאוד ביכולתה של התרופה הזו לטפל בסוגי סרטן רבים, אבל מדובר בתהליך לא פשוט שעשוי להיות אתגר כלכלי משמעותי, ובמיוחד במלנומה יש חלופות טיפוליות. התפתחות הטכנולוגיה הזאת תהיה תלויה ביכולתה לתת ערך לחולים שנכשלו בטיפולים האחרים.
הטכנולוגיה שנחשבת הדור הבא של ה-TIL היא CAR - שילוב בין רעיון של פרופ' זליג אשחר ממכון ויצמן לעבודה של רוזנברג. בשיטה הזאת, באמצעות הנדסה גנטית, משלבים נוגדן מסוים היודע לזהות את הגידול בתא T שיודע לחסל אותו, ויחד הם יוצאים למבצע חיסול הגידול. הטכנולוגיה הזאת קצת יותר פשוטה מ-TIL, מאחר שאין צורך להפיק את התאים דווקא מתוך הגידול.
שימו לב לתוצאות של ה-CAR בטיפול בסרטן של מערכת הדם כמו לוקמיה ולימפומה. "בניסויים קליניים שנערכו עד היום, המוצר הזה מביא לתגובה מושלמת, היעלמות מוחלטת של הגידול לאורך שנים, גם באנשים שניסו ללא הצלחה עשר תרופות קודמות. תגובה משמעותית כלשהי ניכרת ב-90% מהחולים", אומר מרקל. בסוגי סרטן אחרים הטכנולוגיה פועלת פחות טוב בינתיים, אולם מרקל סבור שפיתוח מולקולות CAR חדשות יביא לטיפול יעיל במגוון רחב יותר של סרטנים. מוצרי CAR נמצאים בימים אלה בשלבי II של הניסויים הקליניים ועשויים להגיע לשוק ב-2016-2017.
טילים מונחים לתאים הסרטניים
כבר מותר לדבר שוב על חיסון לסרטן?
שיטות הטיפול החדשות שתוארו כאן מלהיבות, אבל אולי זה הזמן להיזכר בהייפ דומה שהיינו עדים לו רק לפני כמה שנים. אז הוא היה סביב "חיסוני הסרטן". הרעיון היה להפיק מגוף החולה תאים של מערכת החיסון, ללמד אותם להכיר חומרים מסוימים המופיעים אך ורק על הגידול, ואז לשלוח אותם חזרה לתוך הגוף. התוצאות לא היו מלהיבות כמו המוצרים שתוארו לעיל, אבל גם לא זניחות. חברת Dendreon, למשל, דיווחה על הארכה של 4 חודשים בחיי חולים בסרטן הערמונית בשלבים מתקדמים. החודש הגישה Dendreon בקשה לפשיטת רגל. מגוון של כשלים ניהוליים, תמחור מופרז, תהליך ייצור בעייתי והעובדה שמדובר בכל זאת רק ב-4 חודשי חיים הפילה את החברה.
"בעקבות המקרה הזה, הרעיון של חיסון לסרטן הפך למילה גסה בתעשייה", אומרת ד"ר כהן-דייג, "אבל דווקא היום ההערכה היא שניתן לשלב את החיסונים לסרטן עם הטכנולוגיות האחרות של האימונותרפיה, כדי להשיג תוצאה הרבה יותר טובה. ייתכן שהבעיה בחיסון נגד סרטן הייתה, למשל, שהסרטן הצליח לחסום אותו דרך נקודת בקרה, ואם נשחרר את הבלמים החיסון יעבוד מצוין. זה הוכח בניסויים בחיות, ועכשיו נבדק בניסויים בבני אדם".
מנכ"ל קניון גבעתיים: "אני כבר חמש שנים חושב לטווח קצר"
שמואל בין, מנכ"ל קניון גבעתיים, שטופל במכון אלה באימונותרפיה מסוג TIL, חי כבר חמש שנים מעבר למה שניבאו לו בעידן שלפני האימונותרפיה. היום הוא אינו מקבל טיפול כלל וגם לא סובל מתופעות לוואי, אבל הטראומה עדיין חיה. "זה היה סרט אימה", הוא מספר, "היה לי כתם בקרקפת, שבמקרה גילה הספר שלי. הוא אמר לי, 'שמיל, יש לך כתם, כדאי לך ללכת לבדוק אותו'". הוא אכן בדק והתברר שזו מלנומה ממארת. "שאלתי, מה עושים? אמרו שמסירים אותו ובודקים אם הבלוטות נגועות. לשמחתי, הן היו נקיות. אמרו לי, נהדר. כולם מבריאים ממצב כזה".
כעבור שנה וחצי ביצע בין סקר בריאות שגרתי מטעם מקום העבודה והתגלתה גרורה בריאה. "הגעתי למכון אלה, פרופ' שכטר עשה לי תוכנית כימותרפיה, אבל עדיין לא הבנתי את חומרת מצבי", מספר בין, "נכנסתי לכימותרפיה והסבב הראשון היה קשה מנשוא. הרגשתי שאני יוצא ממנו מטורלל לגמרי. לא יכולתי לדבר עם איש". בין אמר שהוא מסרב להיכנס שוב לכימותרפיה, ונענה: זו החלטתך, אך במקרה כזה יש לך 4-8 חודשים לחיות. "זו הייתה הפעם הראשונה שבה דיברו איתי על תוחלת חיים", הוא אומר.
בין עבר שני סבבי כימותרפיה נוספים, ואז שכטר הציע לו טיפול ניסיוני - משאף של אינטרלוקין, הטיפול האימונותרפי הוותיק במלנומה. "שאפתי שלוש פעמים ביום והייתי שמח וטוב לב, אבל הגרורות שבו לגדול", מספר בין. "שאלתי מה עכשיו, ושכטר אמר: זהו. אין יותר מה לעשות. הייתי בטוח שבתוך כמה חודשים אני מחזיר ציוד. כך קרה לכל מי שהיה במצבי".
ואז הוצע לבין הטיפול הניסיוני בשיטת TIL. "הוציאו לי בניתוח גרורה מהריאה, ואז עברתי כימותרפיה של סוסים שהרסה לי את מערכת החיסון והייתי בבידוד מוחלט כי כל זבוב יכול היה להרוג אותי. החזירו לי את תאי החיסון המעובדים עם חומרים נוספים מעודדי חיסון, והיו תופעות קשות מאוד, אבל ב-CT הראשון ראו שהגרורות התחילו להתכווץ. מאז הן מתכווצות כולן וחלקן הגדול נעלם, ללא כל טיפול נוסף. שכטר הציל את חיי, וזו לא קלישאה. היום אני חוגג יום הולדת ב-1 במארס, התאריך שיצאתי מבית החולים, כי אז נולדתי מחדש. היום כל התוכניות שלי הן לטווח קצר. פעם הייתי אסטרטג, עם תוכניות מאוד ארוכות, אבל אף אחד לא שולט בגורל שלו והיום אני מודע לזה הרבה יותר. פעם הייתי מאוד אופטימי, היום אני ריאלי, ובינינו, העדפתי את תפיסת העולם הקודמת שלי, אבל אני יודע שצריך להשתדל ליהנות מכל רגע".

החברות הישראליות